纳米材料的肿瘤血管渗透性是纳米药物递送领域的关键科学问题之一。目前,针对肿瘤的纳米药物设计原理主要是基于1986年发现的血管高渗透和组织长滞留(enhanced permeability and retention, EPR)效应。然而,近年来随着多个纳米药物在临床研究的失败,研究者们开始重新审视这一机制,部分学者在最近的研究中也是公开质疑肿瘤血管是否存在高渗透性,而导致这一问题存在争议的主要原因是缺乏有效的方法来量化肿瘤的血管渗透性。

图1.基于机器学习和蛋白纳米探针建立的Nano-ISML技术
南开大学黄兴禄教授与中科院生物物理所阎锡蕴团队、中科院自动化所田捷团队合作,利用基因工程化蛋白纳米探针,与深度学习的图像分割技术结合,建立了一种高通量定量肿瘤单血管渗透性的新技术,即Nano-ISML,通过自己建立的30多种不同肿瘤模型(>67000根血管)的数据分析,系统揭示了肿瘤血管渗透存在极大异质性,发现不同肿瘤血管的渗透性存在>100倍的差异,并依赖肿瘤类型和血管类型。在此技术帮助下,他们也揭示了血管内皮细胞渗透异质性形成的生物学机制,即高、低渗透性血管分别依赖被动、主动的渗透机制,并针对这种机制提出了针对高渗肿瘤和低渗肿瘤分类设计的新策略。
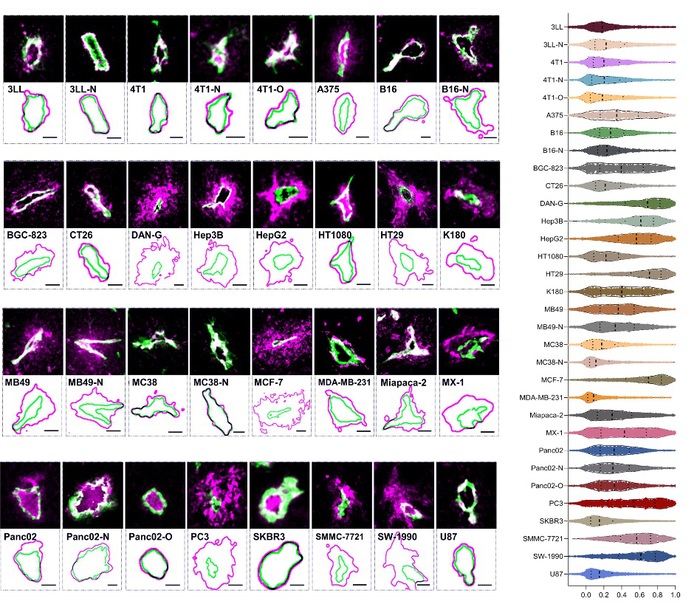
图2.纳米材料在不同肿瘤血管的渗透情况(左)和量化分布(右)
研究成果以“机器学习助力单血管分析纳米材料在肿瘤的血管渗透性”(Machine Learning-assisted Single Vessel Analysis of Nanoparticle Permeability in Tumour Vasculatures)为题,于2023年2月13日在《自然·纳米技术》《Nature Nanotechnology》杂志以长文(article)形式在线发表。该研究建立的Nano-ISML技术实现了血管渗透性分析从定性到定量的跨越,从定量总体的平均渗透性到单血管量化分析的跨越,这种高通量单血管定量分析技术可广泛适用到其它方面的相关研究中,像血管分子机制、药物筛选、药物递送等。揭示的差异化渗透机制和纳米药物设计策略,将为下一代个性化纳米药物的开发提供理论依据和设计原则。该研究深度融合纳米技术、人工智能和合成生物学等领域,也为学科交叉解决关键科学问题提供了一种新范式。
外围买球app十大平台官网2020级博士生朱明盛和医学院庄洁副教授是该论文的共同第一作者,南开大学黄兴禄教授、中科院生物物理所阎锡蕴院士、中科院自动化所田捷教授为论文共同通讯作者。该工作受到国家自然科学基金、国家重点研发计划、天津合成生物学技术创新能力提升行动、南开大学百名青年学科带头人计划等资金支持。
论文链接:https://www.nature.com/articles/s41565-023-01323-4.



